Plumbate Oxide (PbO) Formel, Eigenschaften, Risiken und Nutzen
Die pralles Oxid, auch bekannt als Bleioxid (II) oder Bleimonoxid, ist eine chemische Verbindung der Formel PbO. Es ist in zwei Polymorphe gefunden: die Litharge und der Masicotit. Seine Struktur ist in Abbildung 1 dargestellt.
Zurück zur Zusammensetzung ist Bleiglätte das oxidierte Produkt von geschmolzenem Blei, das gerührt oder atomisiert wurde, um Luft einzubauen, dann abgekühlt und gemahlen, um das gelbe Pulver zu bilden.
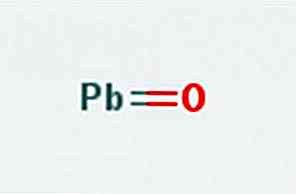
Der Name Masicotit wird sowohl für das native Mineral als auch für das Bleimonoxidprodukt verwendet, das durch Erhitzen von Bleicarbonat auf 300 ° C erzeugt wird (Bleimonoxid, 2016). Diese Mineralien sind in Abbildung 2 dargestellt.

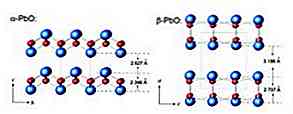
Masicotit hat eine orthorhombische Struktur, während Litharge eine tetragonale kristalline Struktur hat. Bleioxid (II) hat die Fähigkeit, beim Erhitzen oder Abkühlen die Struktur zu verändern. Diese Strukturen sind in Abbildung 3 dargestellt.
PbO wird durch Oxidation von metallischem Blei hergestellt. Das Metall wird geschmolzen, um Bleitabletten herzustellen, und dann zwischen 170 und 210 ° C gemahlen und zur Oxidation bei Temperaturen über 600 ° C durch die Flamme geführt. Die Oxidprodukte werden zerkleinert, um das fertige Bleioxid zu erhalten (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO wird in großem Maßstab als Zwischenprodukt bei der Raffination von Bleimineralien in metallischem Blei hergestellt. Das verwendete Bleimineral ist Bleiglanz (Bleisulfid (II)). Bei hoher Temperatur (1000 ° C) wird der Schwefel auf folgende Weise in das Oxid umgewandelt:
2PbS + 3O2 → 2PbO + 2SO2
Index
- 1 Physikalische und chemische Eigenschaften von Bleioxid
- 2 Reaktivität und Gefahren
- 3 Verwendet
- 4 Referenzen
Physikalische und chemische Eigenschaften von Bleioxid
Bleimonoxid kann zwei verschiedene Erscheinungsformen aufweisen: als gelbes Trockenpulver mit orthorhombischer Struktur (Masicotit) oder als rötliche tetragonale Kristalle (Litharge). Beide Formen sind in Abbildung 4 dargestellt.

Die Verbindung hat ein Molekulargewicht von 223,20 g / mol und eine Dichte von 9,53 g / ml. Es hat einen Schmelzpunkt von 888ºC und einen Siedepunkt von 1470ºC (National Center for Biotechnology Information, S.F.).
Die Verbindung ist in Wasser nicht sehr löslich und kann nur 0,0504 Gramm pro Liter bei 25ºC in Form von Masicotit und 0,1065 Gramm pro Liter bei 25ºC in Form von Bleiglätte auflösen. Die Verbindung ist auch in Alkohol unlöslich. Es ist in Essigsäure, verdünnter HNO3 und Alkalien löslich (Royal Society of Chemistry, 2015).
Die Verbindung ist ein schwach oxidierendes oder reduzierendes Mittel, Redoxreaktionen können jedoch immer noch auftreten. Diese Verbindungen sind nicht mit Wasser reagieren.
Bleioxid oxidiert Aluminiumcarbid beim Erhitzen mit Weißglut. Mischungen aus Bleioxid mit Aluminiumpulver (wie bei anderen Metallen: Natrium, Zirkonium) führen zu einer heftigen Explosion.
Reaktivität und Gefahren
Bleimonoxid ist eine Verbindung, die als giftig eingestuft wird. Die Substanz ist toxisch für das zentrale Nervensystem und kann beim Menschen krebserregend sein (Sicherheitsdatenblatt Bleioxid, gelb, 2013).
Die Symptome der frühen Vergiftung sind Leitzungen, die am Rande des Zahnfleisches erscheinen und die Haut wird gräulich. Das neurasthenische Syndrom wird auch in der Anfangsphase der Vergiftung auftreten.
Kleinhirnvergiftung kann zu Depressionen durch Bleivergiftung, Manie durch Bleivergiftung sowie zu Bleivergiftung und Empfindlichkeit gegenüber multipler Nervenlähmung führen.
Bleivergiftung kann auch hypochrome Anämie und metabolische und endokrine Störungen verursachen. Darüber hinaus kann eine Bleivergiftung die Aktivität bestimmter Enzyme im Verdauungssystem hemmen und Verdauungsstörungen, starke Bauchschmerzen und Leberschäden verursachen. Es kann auch Bluthochdruck und erhöhten Cholesterinspiegel verursachen.
Wenn es starke Bauchschmerzen gibt, können einige Maßnahmen ergriffen werden, wie subkutane Injektion von Atropin und anderen Drogen, heißer Bauch, Einlauf, heißes Wasserbad und so weiter. Die maximal zulässige Konzentration in der Luft beträgt 0,01 mg / m3 (Bleimonoxid, 2016).
Bei Berührung mit den Augen oder der Haut mit viel Wasser abwaschen. Bei Einatmen oder Verschlucken sollte das Opfer an einen belüfteten Ort gebracht werden. Erbrechen sollte nicht induziert werden. Wenn das Opfer nicht atmet, sollte eine Mund-zu-Mund-Beatmung durchgeführt werden.
In allen Fällen sollten Sie sofort ärztliche Hilfe in Anspruch nehmen. Bleimonoxid ist eine schädliche Verbindung für die Umwelt, die Bioakkumulation dieser Chemikalie kann in Pflanzen und Säugetieren auftreten.
Es wird dringend empfohlen, dass dieser Stoff nicht in die Umwelt gelangt, daher muss er gemäß den festgelegten Bestimmungen gehandhabt und gelagert werden (Nationales Institut für Arbeitsschutz und Gesundheit, 2015).
Verwendet
Bleimonoxid wurde als Lacktrockner und als geringer Brandstrom bei der Herstellung von Keramik und Glas verwendet.Bleikristallglas wird bei der Herstellung von hochwertigem Geschirr verwendet.
Durch die Verwendung von Bleimonoxid als Flussmittel kann ein Glas mit einem hohen Brechungsindex und damit dem gewünschten Glanz erhalten werden (Encyclopedia Britannica, 2016).
Halbmetallische keramische Leiter haben die höchsten Leitfähigkeiten aller Keramiken, mit Ausnahme von supraleitenden Keramiken. Bleioxid ist ein Beispiel für diese Art von halbmetallischer Keramik. Diese Materialien haben überlagerte Elektronenenergiebänder und sind daher ausgezeichnete elektronische Leiter (Mason, 2008).
Bleioxid wird hauptsächlich in Elektronenröhren, Bildröhren, optischem Glas, Röntgen-Bleiglas und strahlenresistenten Kautschuken verwendet.
Es dient als analytisches Reagenz, den Fluss von Silikat, aber auch für die Ausfällung von Aminosäuren
Bleioxid wird bei der Herstellung von Kunststoff-PVC-Stabilisatoren verwendet und ist auch das Ausgangsmaterial für andere Bleisalze. Es wird auch bei der Raffination von Öl und zur Bestimmung von Gold und Silber verwendet.
Es wird auch als ein gelbes Pigment in Farben und Emaillen verwendet. Masicotite wurde von Künstlern des 15. bis 18. Jahrhunderts als Pigment verwendet.
Dünne Schichten von Bleimonoxid werden verwendet, um irisierende Farben in Messing und Bronze zu erzeugen. Litharge mischt sich mit Glycerin, um Zement vom Klempner zu machen.
Referenzen
- Britische Enzyklopädie. (2016, 10. Oktober). Glas. Wiederhergestellt von Britannica: britannica.com.
- Kirk-Othmer. (1995). Enzyklopädie der chemischen Technologie. 4. Ausgabe Bände 1. New York: John Wiley und Söhne.
- Bleimonoxid. (2016, 1. Mai). Von cameo.mfa abgerufen: cameo.mfa.org.
- Bleimonoxid. (2016). Aus dem Chemikalienbuch: chemicalbook.com.
- Mason, T. O. (2008, 12. März). Leitfähige Keramik. Wiederhergestellt von Britannica: britannica.com.
- Sicherheitsdatenblatt Bleioxid, gelb. (2013, 21. Mai). Von sciencebab: sciencebek.com.
- Nationales Zentrum für Biotechnologie Information. (S.F.) PubChem Compound-Datenbank; CID = 14827. Von PubChem abgerufen: publem.ncbi.nlm.nih.gov.
- Nationales Institut für Arbeitssicherheit und Gesundheit. (2015, 22. Juli). BLEI (II) OXID. Von cdc.gov: cdc.gov abgerufen.
- Royal Society of Chemistry. (2015). Blei (II) -oxid. Von chemespider: chemspider.com.


