Kalium-Iodat Eigenschaften, Struktur, Anwendungen und Risiken
Die Kaliumiodat oder Kaliumiodat ist eine anorganische Verbindung von Iod, insbesondere ein Salz, dessen chemische Formel KIO ist3. Das Iod, Element der Gruppe der Halogene (F, Cl, Br, I, As), hat in diesem Salz eine Oxidationszahl von +5; deshalb ist es ein starkes Oxidationsmittel. Die KIO3 dissoziiert in wässrigem Medium, um die K-Ionen zu erzeugen+ und IO3-.
Es wird synthetisiert durch Reaktion von Kaliumhydroxid mit Jodsäure: HIO3(aq) + KOH (s) => KIO3(aq) + H2O (l) Es kann auch durch Umsetzen von molekularem Iod mit Kaliumhydroxid: 3I synthetisiert werden2(s) + 6 KOH (s) => KIO3(aq) + 5 KI (aq) + 3H2O (l)

Index
- 1 Physikalische und chemische Eigenschaften
- 1.1 Oxidationsmittel
- 2 Chemische Struktur
- 3 Verwendet und Anwendungen von Kaliumiodat
- 3.1 Therapeutische Verwendung
- 3.2 Verwendung in der Industrie
- 3.3 Analytischer Gebrauch
- 3.4 Verwendung in der Lasertechnologie
- 4 Gesundheitsrisiken von Kaliumiodat
- 5 Referenzen
Physikalische und chemische Eigenschaften
Es ist ein geruchloser weißer Feststoff mit feinen Kristallen und einer kristallinen Struktur vom monoklinen Typ. Es hat eine Dichte von 3,98 g / ml, ein Molekulargewicht von 214 g / mol und Absorptionsbanden im Infrarot (IR) -Spektrum.
Es hat einen Schmelzpunkt: 833 ° K (560 ° C), was mit den starken ionischen Wechselwirkungen zwischen den K-Ionen übereinstimmt+ und IO3-. Bei höheren Temperaturen erfährt es eine thermische Zersetzungsreaktion unter Freisetzung von molekularem Sauerstoff und Kaliumiodid:
2KIO3(s) => 2 KI (s) + 3O2(G)
In Wasser hat es Löslichkeiten im Bereich von 4,74 g / 100 ml bis 0 ºC bis zu 32,3 g / 100 ml bei 100 ºC, wobei farblose wäßrige Lösungen erzeugt werden. Außerdem ist es in Alkohol und Salpetersäure unlöslich, aber in verdünnter Schwefelsäure löslich.
Seine Affinität zu Wasser ist nicht nennenswert, weshalb es nicht hygroskopisch ist und nicht in Form von hydratisierten Salzen (KIO) vorliegt.3· H2O).
Oxidationsmittel
Kaliumiodat weist, wie seine chemische Formel zeigt, drei Sauerstoffatome auf. Dies ist ein stark elektronegatives Element und aufgrund dieser Eigenschaft "deckt" es einen elektronischen Mangel in der Wolke auf, die das Iod umgibt.
Dieser Mangel - oder Beitrag - kann als die Oxidationszahl des Iods (± 1, +2, +3, +5, +7) berechnet werden und für den Fall dieses Salzes +5 betragen.
Was bedeutet das? Vor einer Spezies, die ihre Elektronen abgeben kann, wird Jod sie in ihrer ionischen Form annehmen3-) zu molekularem Jod werden und eine Oxidationszahl von 0 haben.
Nach dieser Erklärung kann festgestellt werden, dass Kaliumiodat eine oxidierende Verbindung ist, die in vielen Redoxreaktionen stark mit Reduktionsmitteln reagiert; Von all diesen ist man als Joduhr bekannt.
Die Joduhr besteht aus einem Redoxprozess von langsamen und schnellen Schritten, in dem die schnellen Schritte durch eine KIO-Lösung markiert werden3 in Schwefelsäure, der Stärke zugesetzt wird. Als nächstes wird die Stärke - einmal hergestellt und zwischen ihren Strukturarten verankert3-- wird die Lösung farblos zu dunkelblau machen.
IO3− + 3 HSO3− → Ich− + 3 HSO4−
IO3− + 5 Ich− + 6 Stunden+ → 3 Ich2 + 3 H2O
Ich2 + HSO3− + H2O → 2 I− + HSO4− + 2 H+ (dunkelblau durch Stärkeeffekt)
Chemische Struktur
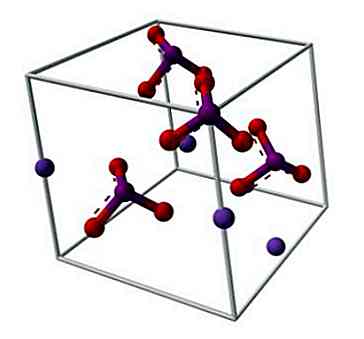
Die chemische Struktur von Kaliumiodat ist im oberen Bild dargestellt. Das IO-Anion3- wird durch das "Stativ" aus roten und violetten Kugeln repräsentiert, während die K-Ionen+ sie werden durch die violetten Kugeln dargestellt.
Aber was bedeuten diese Stative? Die korrekten geometrischen Formen dieser Anionen sind eigentlich trigonale Pyramiden, in denen die Sauerstoffatome die dreieckige Basis bilden, und das nicht geteilte Elektronenpaar des Jods zeigt nach oben, besetzt den Raum und zwingt die IO-Verbindung nach unten und die beiden Links I = O.
Diese molekulare Geometrie entspricht einer sp-Hybridisierung3 des zentralen Iodatoms; eine andere Perspektive legt jedoch nahe, dass eines der Sauerstoffatome Bindungen mit den "d" -Orbitalen des Jods bildet, was tatsächlich eine sp-Hybridisierung ist3d2 (Das Iod kann seine "d" -Orbitale haben, die seine Valenzschicht erweitern).
Die Kristalle dieses Salzes können als Folge der unterschiedlichen physikalischen Bedingungen, die sie bedingen, strukturelle Phasenübergänge (andere Anordnungen als die monokline) eingehen.
Verwendet und Anwendungen von Kaliumiodat
Therapeutische Verwendung
Kaliumjodat wird in der Regel verwendet, um die Anhäufung von Radioaktivität in der Schilddrüse in Form von zu verhindern 131I, wenn dieses Isotop bei der Bestimmung der Jodaufnahme durch die Schilddrüse als Bestandteil der Schilddrüsenfunktion eingesetzt wird.
In ähnlicher Weise wird Kaliumiodat als topisches Antiseptikum (0,5%) bei Schleimhautinfektionen verwendet.
Verwendung in der Industrie
Es wird der Nahrung der Nutztiere als Jodzusatz beigefügt. Daher wird in der Industrie Kaliumiodat verwendet, um die Qualität der Mehle zu verbessern.
Analytischer Gebrauch
In der analytischen Chemie wird es aufgrund seiner Stabilität als Primärstandard bei der Standardisierung von Natriumthiosulfat - Standardlösungen (Na2S2O3), um die Jodkonzentrationen in den Proben zu bestimmen.
Dies bedeutet, dass die Mengen an Iod durch volumetrische Techniken (Titrationen) bekannt sein können. Bei dieser Reaktion oxidiert Kaliumiodat Iodidionen I schnell-, mittels der folgenden chemischen Gleichung:
IO3- + 5I- + 6H+ => 3I2 + 3H2O
Jod, ich2, ist mit der Lösung von Na betitelt2S2O3 für seine Standardisierung.
Verwendung in der Lasertechnologie
Studien haben die interessanten piezoelektrischen, pyroelektrischen, elektrooptischen, ferroelektrischen Eigenschaften und in der nichtlinearen Optik von KIO-Kristallen gezeigt und bestätigt3. Daraus ergibt sich ein großes Potential in der Elektronik und in der Technologie von Lasern für Materialien, die mit dieser Verbindung hergestellt werden.
Gesundheitsrisiken von Kaliumiodat
In hohen Dosen können Reizungen der Mundschleimhaut, Haut, Augen und Atemwege verursachen.
Experimente zur Toxizität von Kaliumiodat bei Tieren haben gezeigt, dass bei Nüchternhunden bei einer Dosis von 0,2 bis 0,25 g / kg Körpergewicht, die oral verabreicht wird, Erbrechen verursacht wird.
Werden diese Erbrochenheiten vermieden, so führt dies zu einer Verschlechterung der Situation bei den Tieren, da es vor dem Tod zu Anorexie und Erschöpfung führt. Seine Autopsien erlaubten nekrotische Läsionen in Leber, Nieren und Darmschleimhaut zu beobachten.
Aufgrund seiner Oxidationskraft stellt es eine Brandgefahr dar, wenn es mit brennbaren Materialien in Berührung kommt.
Referenzen
- Tag, R., & Underwood, A. Quantitative analytische Chemie (fünfte Ausgabe). PEARSON Prentice Hall, S. 364.
- Muth, D. (2008). Laser. [Abbildung]. Von: flickr.com
- Chemisches Buch. (2017). Kaliumiodat. Abgerufen am 25. März 2018 von ChemicalBook: chemicalbook.com
- PubChem. (2018). Kaliumiodat. Abgerufen am 25. März 2018 von PubChem: publem.ncbi.nlm.nih.gov
- Merck. (2018). Kaliumiodat. Am 25. März 2018 von Merck bezogen:
- merckmillipore.com
- Wikipedia. (2017). Kaliumiodat. Abgerufen am 25. März 2018 von Wikipedia: en.wikipedia.org
- M Abdel Kader et al. (2013). Ladungstransportmechanismus und Phasenübergänge bei niedriger Temperatur in KIO3. J. Phys.: Konf. Ser. 423 012036


