Hybridisierung von Kohlenstoff in was es besteht, Arten und ihre Eigenschaften
Die Kohlenstoff-Hybridisierung beinhaltet die Kombination von zwei reinen Atomorbitalen, um ein neues "Hybrid" -Molekülorbital mit seinen eigenen Eigenschaften zu bilden. Der Begriff des Atomorbitals liefert eine bessere Erklärung als das vorherige Konzept der Umlaufbahn, um eine Näherung dafür zu finden, wo es eine größere Wahrscheinlichkeit gibt, ein Elektron in einem Atom zu finden.
Mit anderen Worten, ein Atomorbital ist die Darstellung der Quantenmechanik, um eine Vorstellung von der Position eines Elektrons oder Elektronenpaares in einem bestimmten Bereich innerhalb des Atoms zu geben, wobei jedes Orbital entsprechend den Werten seiner Zahlen definiert ist Quantum

Die Quantenzahlen beschreiben zu einem bestimmten Zeitpunkt den Zustand eines Systems (wie das des Elektrons innerhalb des Atoms) durch die zum Elektron (n) gehörende Energie, den Drehimpuls, den es in seiner Bewegung beschreibt (l), das damit verbundene magnetische Moment (m) und der Spin des Elektrons, während es sich innerhalb des Atoms (der Atome) bewegt.
Diese Parameter sind für jedes Elektron in einem Orbital einzigartig, so dass zwei Elektronen nicht genau dieselben Werte der vier Quantenzahlen haben können und jedes Orbital kann höchstens von zwei Elektronen besetzt sein.
Index
- 1 Was ist Kohlenstoff-Hybridisierung?
- 2 Haupttypen
- 2.1 Sp3-Hybridisierung
- 2.2 Hybridisierung sp2
- 2.3 Hybridisierung sp
- 3 Referenzen
Was ist die Hybridisierung von Kohlenstoff?
Um die Hybridisierung von Kohlenstoff zu beschreiben, muss berücksichtigt werden, dass die Eigenschaften jedes Orbitals (seine Form, Energie, Größe usw.) von der elektronischen Konfiguration jedes Atoms abhängen.
Das heißt, die Eigenschaften jedes Orbitals hängen von der Anordnung der Elektronen in jeder "Schicht" oder Ebene ab: von der am nächsten zum Kern liegenden bis zur äußersten, auch Valenzschale genannt.
Die Elektronen der äußersten Ebene sind die einzigen, die verfügbar sind, um eine Bindung zu bilden. Wenn daher eine chemische Bindung zwischen zwei Atomen gebildet wird, wird die Überlappung oder Überlappung zweier Orbitale (eines von jedem Atom) erzeugt, und dies ist eng mit der Geometrie der Moleküle verbunden.
Wie oben ausgeführt, kann jedes Orbital mit maximal zwei Elektronen befüllt werden, jedoch muss das Aufbau - Prinzip befolgt werden, bei dem die Orbitale entsprechend ihrem Energieniveau (von der niedrigsten bis zur höchsten) gefüllt werden zeigt unten:

Auf diese Weise wird Level 1 zuerst gefüllts, dann 2s, gefolgt von 2p und so weiter, abhängig davon, wie viele Elektronen das Atom oder Ion hat.
Somit ist die Hybridisierung ein Phänomen, das Molekülen entspricht, da jedes Atom nur reine Atomorbitale liefern kann (s, p, d, f) und aufgrund der Kombination von zwei oder mehr Atomorbitalen wird die gleiche Anzahl von Hybridorbitalen gebildet, die die Verbindungen zwischen Elementen ermöglichen.
Haupttypen
Atomorbitale haben unterschiedliche Formen und räumliche Orientierungen, deren Komplexität sich wie folgt erhöht:

Es wird beobachtet, dass es nur eine Art von Orbital gibt s (Kugelform), drei Arten von Orbital p (lobuläre Form, wo jeder Lappen auf einer räumlichen Achse orientiert ist), fünf Arten von Orbital d und sieben Arten von Orbital f, wo jede Art von Orbital genau die gleiche Energie hat wie ihre Art.
Das Kohlenstoffatom in seinem Grundzustand hat sechs Elektronen, deren Konfiguration 1 ists22s22p2. Das heißt, sie sollten Level 1 belegens (zwei Elektronen), die 2s (zwei Elektronen) und teilweise 2p (die restlichen zwei Elektronen) nach dem Aufbauprinzip.
Dies bedeutet, dass das Kohlenstoffatom im Orbital 2 nur zwei ungepaarte Elektronen aufweistp, aber es ist nicht möglich, die Bildung oder Geometrie des Methanmoleküls (CH4) oder andere komplexere.
Um diese Bindungen zu bilden, brauchen Sie die Hybridisierung der Orbitale s und p (im Fall von Kohlenstoff), um neue Hybridorbitale zu erzeugen, die sogar Doppel- und Dreifachbindungen erklären, wobei Elektronen die stabilste Konfiguration für die Bildung von Molekülen erhalten.
Hybridisierung sp3
Hybridisierung sp3 besteht aus der Bildung von vier "hybriden" Orbitalen aus den 2s, 2p-Orbitalenx, 2pund und 2pz rein
Wir haben also die Umlagerung der Elektronen in Ebene 2, wo vier Elektronen für die Bildung von vier Bindungen zur Verfügung stehen und sie parallel angeordnet sind, um eine niedrigere Energie (größere Stabilität) zu haben.
Ein Beispiel ist das Ethylenmolekül (C2H4), deren Verbindungen 120 ° Winkel zwischen den Atomen bilden und eine flache trigonale Geometrie liefern.
In diesem Fall werden einfache C-H- und C-C-Bindungen erzeugt (aufgrund von Orbitalen). sp2) und eine doppelte CC-Bindung (aufgrund des Orbitals p), um das stabilste Molekül zu bilden.

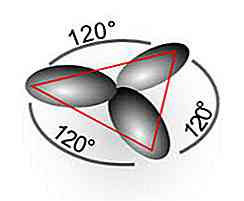
Hybridisierung sp2
Durch sp-Hybridisierung2 Drei "Hybrid" -Orbitale werden aus dem reinen 2s-Orbital und drei reinen 2p-Orbitalen erzeugt. Zusätzlich wird ein reines p-Orbital erhalten, das an der Bildung einer Doppelbindung (Pi: "π") beteiligt ist.
Ein Beispiel ist das Ethylenmolekül (C2H4), deren Verbindungen 120 ° Winkel zwischen den Atomen bilden und eine flache trigonale Geometrie liefern. In diesem Fall werden einfache C-H- und C-C-Bindungen erzeugt (aufgrund von sp-Orbitalen).2) und eine doppelte CC-Bindung (aufgrund des p-Orbitals), um das stabilste Molekül zu bilden.
 Hybridisierung sp
Hybridisierung sp
Durch sp-Hybridisierung entstehen zwei "Hybrid" -Orbitale aus dem reinen 2s-Orbital und drei reinen 2p-Orbitalen. Auf diese Weise entstehen zwei reine p-Orbitale, die an der Bildung einer Dreifachbindung beteiligt sind.
Für diese Art der Hybridisierung wird das Acetylenmolekül (C) als Beispiel angeführt2H2), deren Verbindungen 180 ° Winkel zwischen den Atomen bilden und eine lineare Geometrie liefern.
Für diese Struktur gibt es einfache C-H- und C-C-Bindungen (aufgrund der sp-Orbitale) und eine dreifache CC-Bindung (das heißt zwei Pi-Bindungen aufgrund der p-Orbitale), um die Konfiguration mit weniger elektronischer Abstoßung zu erhalten.

Referenzen
- Orbitalhybridisierung. Erholte sich von en.wikipedia.org
- Fox, M. A. und Whitesell, J. K. (2004). Organische Chemie Wiederhergestellt von books.google.co.ve
- Carey, F.A. und Sundberg, R.J. (2000). Fortgeschrittene Organische Chemie: Teil A: Struktur und Mechanismen. Wiederhergestellt von books.google.co.ve
- Anslyn, E. V. und Dougherty, D. A. (2006). Moderne physikalische organische Chemie. Wiederhergestellt von books.google.co.ve
- Mathur, R. B .; Singh, B. P. und Pande, S. (2016). Kohlenstoff-Nanomaterialien: Synthese, Struktur, Eigenschaften und Anwendungen. Wiederhergestellt von books.google.co.ve



 Hybridisierung sp
Hybridisierung sp