Aluminium Sulfide (Al2S3) Chemische Struktur, Nomenklatur Eigenschaften
Die Aluminiumsulfid (Al2S3) ist eine hellgraue chemische Verbindung, die durch die Oxidation von metallischem Aluminium durch den Verlust der Elektronen des letzten Energieniveaus und die Bildung von Kationen und durch die Reduktion von nichtmetallischem Schwefel gebildet wird, indem die von Aluminium gewonnenen Elektronen gewonnen werden und zu einem Anion.
Damit dies geschieht und das Aluminium seine Elektronen abgeben kann, ist es notwendig, drei Hybrid-Orbitalsp3, die die Möglichkeit geben, Bindungen mit Elektronen aus Schwefel zu bilden.

Die Empfindlichkeit von Aluminiumsulfid gegenüber Wasser bedeutet, dass es in Gegenwart von Wasserdampf in der Luft reagieren kann, um Aluminiumhydroxid (Al (OH)) zu erzeugen.3), Schwefelwasserstoff (H2S) und Wasserstoff (H2gasförmig; Wenn sich Letzteres anhäuft, kann es zu einer Explosion kommen. Daher sollte die Verpackung von Aluminiumsulfid mit luftdichten Behältern erfolgen.
Da andererseits das Aluminiumsulfid eine Reaktivität mit Wasser aufweist, macht es dies zu einem Element, das in dem genannten Lösungsmittel nicht löslich ist.
Index
- 1 Chemische Struktur
- 1.1 Molekulare Formel
- 1.2 Strukturformel
- 2 Nomenklatur
- 3 Eigenschaften
- 3.1 Physikalische Eigenschaften
- 3.2 Chemische Eigenschaften
- 4 Anwendungen und Anwendungen
- 4.1 In Superkondensatoren
- 4.2 In sekundären Lithiumbatterien
- 5 Risiken
- 5.1 Erste-Hilfe-Verfahren
- 5.2 Maßnahmen zur Brandbekämpfung
- 6 Referenzen
Chemische Struktur
Molekulare Formel
Al2S3
Strukturelle Formel
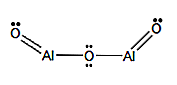 Nomenklatur
Nomenklatur
- Aluminiumsulfid.
- Di-Aluminiumtrisulfid.
- Aluminiumsulfid (III).
- Aluminiumsulfid.
Eigenschaften
Die chemischen Verbindungen weisen meistens zwei Arten von Eigenschaften auf: physikalisch und chemisch.
Physikalische Eigenschaften
Molare Masse
150,158 g / mol
Dichte
2,02 g / ml
Schmelzpunkt
1100 ° C
Wasserlöslichkeit
Unlösbar
Chemische Eigenschaften
Eine der Hauptreaktionen von Aluminiumsulfid ist mit Wasser als Substrat oder Hauptreagenz:

Bei dieser Reaktion kann die Bildung von Aluminiumhydroxid und Schwefelwasserstoff beobachtet werden, wenn es in Form eines Gases vorliegt, oder von Schwefelwasserstoff, wenn es in Wasser in Form einer Lösung gelöst wird. Seine Anwesenheit wird durch den Geruch von faulen Eiern identifiziert.
Anwendungen und Anwendungen
In Superkondensatoren
Aluminiumsulfid wird bei der Herstellung von Nano-Netzwerkstrukturen verwendet, die die spezifische Oberfläche und elektrische Leitfähigkeit verbessern, so dass eine hohe Kapazität und Energiedichte erreicht werden kann, deren Anwendbarkeit die von Superkondensatoren ist.
Graphenoxid (GO) - Graphen ist eine der allotropen Formen von Kohlenstoff - hat als Träger für Aluminiumsulfid (Al2S3) mit einer ähnlichen hierarchischen Morphologie wie die nach der hydrothermalen Methode hergestellte Nanoraptan.
Graphenoxid-Wirkung
Die Eigenschaften von Graphenoxid als Träger, sowie die hohe elektrische Leitfähigkeit und die Oberfläche, machen das Nanoramutant Al2S3 elektrochemisch aktiv sein.
CV-spezifische Kapazitätskurven mit wohldefinierten Redoxpeaks bestätigen das pseudo-kapazitive Verhalten von Alorambutanen Al2S3 Hierarchisch, in Graphenoxid in 1 M NaOH-Elektrolyt gehalten. Die CV-spezifischen Kapazitätswerte, die aus den Kurven erhalten wurden, sind: 168,97 bei einer Abtastgeschwindigkeit von 5 mV / s.
Außerdem wurde eine gute galvanostatische Entladungszeit von 903 μs beobachtet, eine große spezifische Kapazität von 2178,16 bei der Stromdichte von 3 mA / Cm2. Die aus der galvanostatischen Entladung berechnete Energiedichte beträgt 108,91 Wh / kg bei einer Stromdichte von 3 mA / cm2.
Die elektrochemische Impedanz bestätigt somit die pseudokapazitive Natur der hierarchischen Nano-Brummelektrode Al2S3. Der Elektrodenstabilitätstest zeigt eine Beibehaltung der spezifischen Kapazität von 57,44% von bis zu 1000 Zyklen.
Die experimentellen Ergebnisse deuten darauf hin, dass der Nanoramutant Al2S3 Hierarchical ist für Superkondensatoranwendungen geeignet.
In sekundären Lithiumbatterien
Mit der Absicht, eine Lithiumsekundärbatterie mit hoher Energiedichte zu entwickeln, wird das Aluminiumsulfid (Al2S3) als aktives Material.
Die anfängliche Entladungskapazität, gemessen von Al2S3 betrug ungefähr 1170 mAh g & supmin; ¹ bei 100 mA g & supmin; ¹. Dies entspricht 62% der theoretischen Kapazität für Schwefel.
Das Al2S3 zeigten eine geringe Kapazitätserhaltung im Potentialbereich zwischen 0,01 V und 2,0 V, hauptsächlich aufgrund struktureller Irreversibilität des Ladeprozesses oder Li-Extraktion.
Die XRD- und K-XANES-Analysen für Aluminium und Schwefel zeigten, dass die Oberfläche von Al2S3 Reagiert während des Lade- und Entladevorgangs reversibel, während der Al-Kern2S3 zeigte strukturelle Irreversibilität, weil LiAl und Li2S wurden aus Al gebildet2S3 im ersten Download und dann blieben sie wie sie waren.
Risiken
- Im Kontakt mit Wasser entstehen brennbare Gase, die spontan verbrennen können.
- Verursacht Hautreizungen.
- Verursacht schwere Augenreizung.
- Kann die Atemwege reizen.
Die Informationen können je nach Verunreinigungen, Zusatzstoffen und anderen Faktoren variieren.
Erste-Hilfe-Verfahren
Allgemeine Behandlung
Suchen Sie einen Arzt auf, wenn die Symptome anhalten.
Spezielle Behandlung
Keine
Wichtige Symptome
Keine
Einatmen
Nimm das Opfer nach draußen. Geben Sie Sauerstoff, wenn die Atmung schwierig ist.
Verschlucken
Ein oder zwei Gläser Wasser geben und Erbrechen herbeiführen. induziert nie Erbrechen oder etwas durch den Mund einflößen.
Haut
Waschen Sie den betroffenen Bereich mit Wasser und milder Seife. Kontaminierte Kleidung entfernen.
Augen
Wasche deine Augen mit Wasser und blinkle oft für einige Minuten. Entfernen Sie die Kontaktlinsen, wenn Sie sie haben und spülen Sie weiter.
Maßnahmen zur Brandbekämpfung
Entflammbarkeit
Nicht brennbar
Löschmittel
Reagiert mit Wasser. Kein Wasser verwenden: CO2, Sand und Löschpulver verwenden.
Kampfverfahren
Verwenden Sie ein umluftunabhängiges Atemschutzgerät mit vollem Schutz. Tragen Sie Kleidung, um den Kontakt mit Haut und Augen zu vermeiden.
Referenzen
- Gesundheit und Riesgos.com (S. F), Definition, Konzepte und Artikel über Gesundheit und Umweltrisiken. Wiederhergestellt: saludyriesgos.com
- Aluminiumsulfid. (ss) Auf Wikiwand. Abgerufen am 9. März 2018: wikiwand.com
- Web Elements. (S.f) .Dialuminium Trisulpfid, gewonnen am 10. März 2018: webelements.com
- Iqbal, M., Hassan, M., M., Bibi.S., Parveen, B. (2017). Hohe spezifische Kapazität und Energiedichte von Graphenoxid synthetisiert basierend Hierarchical Al2S3 Nanorambutan für Supercapacitor Anwendung, Elektrochimica Acta, Band 246 , Seiten 1097-1103
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). Elektrochemische Eigenschaften von Aluminiumsulfid zur Verwendung in Lithiumbatterien.Journal der Energiequellen,Band 195, Ausgabe 24, Seiten 8327-8330 doi.org
- LTS Research Laboratories, Inc (2016), Sicherheitsdatenblatt Aluminiumsulfid: ltschem.com



 Nomenklatur
Nomenklatur