Chemische Struktur des Aluminiumoxyds (Al2O3), Anwendungen, Eigenschaften
Die Aluminiumoxid (Al2O3 der chemischen Formel), auch Aluminiumoxid, Aluminiumoxid, Korund oder Aluminiumtrioxid genannt, ist ein Metalloxid, das aus der Reaktion zwischen einem Metall und Sauerstoff (O) hergestellt wird. Es ist auch bekannt als basisches Oxid für die Leichtigkeit der Bildung von Hydroxiden, wenn sie mit Wasser reagieren.
Dies liegt daran, dass das Aluminium, das in der IIIA-Familie des Periodensystems liegt, dazu neigt, die Elektronen des letzten Energieniveaus zu liefern. Diese Tendenz beruht auf seiner metallischen Natur und seiner geringen Elektronegativität (1.61 auf der Pauling-Skala), die ihm elektropositive Eigenschaften verleiht und ihn in ein Kation umwandelt.

Im Gegensatz dazu ist Sauerstoff ein Nichtmetall und aufgrund seiner hohen Elektronegativität elektronegativer (3,44 auf der Pauling-Skala). Daher neigt es dazu, die elektronische Energie seines letzten Niveaus zu stabilisieren, indem es Elektronen annimmt, was es zu einem Anion macht.
Die gebildeten Bindungen sind starke Bindungen, die dem Aluminiumoxid eine große Festigkeit verleihen. In der Natur wird Aluminium nicht in nativer Form wie Gold, Silber, Kupfer, Schwefel und Kohlenstoff (Diamant) gefunden.
Dies bedeutet, dass Aluminium nicht mit anderen Elementen kombiniert wird. Dieses Metall ist mit Sauerstoff vermischt und bildet Verbindungen wie Korund oder Schmirgel, die sehr widerstandsfähige und abrasive Verbindungen sind.
Index
- 1 Formel und chemische Struktur
- 2 physikalische Eigenschaften
- 3 chemische Eigenschaften
- 4 Verwendet
- 5 Referenzen
Formel und chemische Struktur
Molekülformel: Al2O3
Strukturformel: 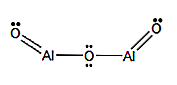
Physikalische Eigenschaften
- Es ist im Handel als weißes Pulver, geruchlos und ungiftig.
- Als Mineralverbindung entspricht die Gruppe der Hämatit. Es ist ein sehr hartes Material, das eine hohe Verschleißfestigkeit aufweist, so dass es als abrasives Material verwendet wird.
- Es leitet leicht Strom und ist auch ein guter Wärmeleiter.
- Es ist resistent gegen Reaktionen mit Säuren und Basen bei hohen Temperaturen.
- Es kann in verschiedenen Farben erscheinen: Rot oder Rubin (wo Aluminiumionen durch Cr ersetzt wurden)3+), gelb, pink, saphirblau, lila, grün, grau und sogar farblos.
- Seine Helligkeit ist glasig oder Adamantin (Diamant)
- Es hat einen sehr feinen weißen Streifen aufgrund seiner Härte.
- Seine Härte in der Mohs-Skala ist 9. Das bedeutet, dass es andere Minerale mit geringerer Härte kratzen kann; es kann jedoch den Diamanten, der eine Härte von 10 auf der gleichen Skala hat, nicht zerkratzen.
- Seine Dichte beträgt 3,96 g / cm3
- Sein Molekulargewicht (Molmasse) beträgt 101,96 g / mol.
- Sein Schmelzpunkt ist 2040 ° C.
- Sein Siedepunkt beträgt 2977 ° C.
- Es ist in Wasser unlöslich.
Chemische Eigenschaften
Aluminiumoxid reagiert nicht mit Wasser, wenn es nicht in Gegenwart einer starken Base vorliegt.
Wenn es jedoch mit Säuren reagiert, verhält es sich wie eine Base:

Es zeigt auch saure Eigenschaften, wenn es mit Basen umgesetzt wird:

Obwohl in dieser Reaktion kein Wasser gebildet wird, wird es wegen Al als Säure-Base betrachtet2O3 neutralisiert NaOH. Daher ist das Al2O3 Es wird als amphoteres Oxid klassifiziert, da es sowohl saure als auch basische Eigenschaften aufweist.
Bei der Bildung von Alkenen und Cycloalkenen ist eine der am häufigsten verwendeten Formen in der Industrie und im Labor die Dehydratisierung von Alkoholen.
Dazu wird Alkoholdampf auf einem heißen Katalysator aus Aluminiumoxid oder Aluminiumoxid (Al2O3); in diesem Fall wird es als Lewis-Säure betrachtet.

Verwendet
- Aluminiumoxid wird in der Industrie verwendet, um Aluminium zu gewinnen.
- Es wird als keramisches Material wegen seiner hohen Korrosionsbeständigkeit bei hohen Temperaturen und Verschleiß verwendet.
- Es wird als Wärmedämmung insbesondere in Elektrolysezellen eingesetzt.
- Es hat die Fähigkeit, Wasser zu absorbieren, wodurch es sich als Trockenmittel eignet.
- Es wird als Katalysator in chemischen Reaktionen verwendet
- Aufgrund seiner hohen thermischen Stabilität wird es als Oxidationsmittel bei chemischen Reaktionen eingesetzt, die bei hohen Temperaturen durchgeführt werden.
- Verhindert die Oxidation von Kathoden- und Anodenanschlüssen in einer Elektrolysezelle.
- Aufgrund seiner großen Härte und Beständigkeit wird es in der Zahnmedizin zur Herstellung von Zahnersatz verwendet.
- Es ist ein guter elektrischer Isolator in den Zündkerzen von Fahrzeugen, die mit Benzin arbeiten.
- Es ist weit verbreitet in Kugelmühlen für die Herstellung von Keramik und Emaille.
- Aufgrund seines geringen Gewichts wird es in technischen Prozessen zur Herstellung von Flugzeugen verwendet.
- Wegen seines hohen Siedepunktes wird es zur Herstellung von Küchengeräten wie Pfannen und feuerfesten Pfannen verwendet.
- Es wird in der Instrumentierung von thermischen Prüfmaschinen verwendet.
- In der Elektronikindustrie wird es bei der Herstellung von passiven Komponenten für die elektrische Verbindung und bei der Herstellung von Widerständen und Kondensatoren verwendet.
- Verwendet in der Herstellung von Füllern für das Schweißen.
- Aluminiumoxid wird zur Beschichtung von Titanoxid (Pigment für Farben und Kunststoffpapiere) verwendet.Dies verhindert Reaktionen zwischen der Umwelt und dieser Art von Pigmenten, die sich nicht zersetzen oder rosten.
- Es wird als Schleifmittel in Zahnpasten verwendet.
- Es wird in der Hämodialyse verwendet.
- Als Additiv in der Lebensmittelindustrie, da es als Dispergiermittel verwendet wird.
- Es ist ein Antitranspirant-Agent von Deodorants.
- Als orthopädisches Material wurde Aluminiumoxid verwendet. Da es sich um ein inertes und poröses Material handelt, ist es für den Einsatz in dieser Art von Implantaten geeignet. Diese Implantate ermöglichen ein fibrovaskuläres Wachstum, weshalb sich Fibroblasten und Osteoblasten in diesem Material schnell vermehren.
- Das biokeramische Implantat besteht aus Aluminiumoxid. Es ist leicht und hat eine gleichmäßige Porenstruktur, die sehr gut miteinander verbunden sind. Die mikrokristalline Struktur ist glatter als die raue Oberfläche. Es zeigt eine geringere Entflammbarkeit nach einer postoperativen Phase im Vergleich zu anderen Materialien, die für Implantate verwendet werden.
- Aluminiumoxid-Flakes erzeugen reflektierende Effekte in Automobillacken.
- In einigen Raffinerien wird Aluminiumoxid zur Umwandlung der giftigen Schwefelwasserstoffgase in elementaren Schwefel verwendet.
- Die Form von Aluminiumoxid, die als aktiviertes Aluminiumoxid bezeichnet wird, hat große Vorteile bei der Behandlung von Abwasser, wie z. B. Aquiferen, da es viele umweltschädliche Schadstoffe adsorbieren kann und auch Abfallstoffe, die in Wasser gelöst sind, filtern kann größer als die Poren der Aluminiumoxidschichten.
Referenzen
- Chang, R; Chemie, 1992, (vierte Ausgabe), Mexiko. McGraw-Hill Interamericana de México.
- Pine.S; Hendrickson, J; Cram, D; Hammond, G (1980), Organische Chemie, (vierte Ausgabe), Mexiko, McGraw-Hill de México
- Kinjanjui, L., (s.f) Eigenschaften und Verwendung von Aluminiumoxid,Es funktioniert immer noch, Wiederhergestellt, itstillworks.com
- Panjian L., Chikara, O., Tadashi, K., Kazuki, N., Naohiro, S., und Klaas de G., (1994). Die Rolle von hydratisiertem Siliciumdioxid, Titandioxid und Aluminiumoxid bei der Induktion von Apatit auf Implantaten. Journal of Biomedicals Materialien Forschung. Band 18, S. 7-15. DOI: 10.1002 / jbm.820280103.
- Vollständiger Informationsführer zu Gesteinen, Mineralien und Edelsteinen., Mineral.net., Zurückgewonnen, minerals.net
- LaNore, S. (2017), Physikalische Eigenschaften von Aluminiumoxid, Erleben,Wiederhergestellt, scening.com



