Berylliumoxid (BeO) -Struktur, Eigenschaften und Verwendungen
Die Berylliumoxid (BeO) ist ein keramisches Material, das neben seiner hohen Festigkeit und seinem spezifischen elektrischen Widerstand eine hohe Wärmeleitfähigkeit aufweist, die es zu Kernreaktoren macht und selbst die Metalle in dieser letzten Eigenschaft übertrifft.
Zusätzlich zu seiner Nützlichkeit als synthetisches Material kann es auch in der Natur gefunden werden, obwohl es selten ist. Das Management muss sorgfältig durchgeführt werden, da es die Gesundheit der Menschen ernsthaft schädigen kann.
In der modernen Welt wurde beobachtet, wie Wissenschaftler, die mit Technologieunternehmen verbunden sind, Forschungen betrieben haben, um fortschrittliche Materialien für ganz spezielle Anwendungen zu entwickeln, beispielsweise solche, die Halbleitermaterialien und die der Luftfahrtindustrie treffen.
Das Ergebnis war die Entdeckung von Substanzen, die uns dank ihrer äußerst nützlichen Eigenschaften und ihrer hohen Haltbarkeit die Möglichkeit gegeben haben, rechtzeitig voranzuschreiten und es uns zu ermöglichen, unsere Technologie auf ein höheres Niveau zu bringen.
Index
- 1 Chemische Struktur
- 2 Eigenschaften
- 2.1 Elektrische Leitfähigkeit
- 2.2 Wärmeleitfähigkeit
- 2.3 Optische Eigenschaften
- 2.4 Gesundheitsrisiken
- 3 Verwendet
- 3.1 Elektronische Anwendungen
- 3.2 Nukleare Anwendungen
- 3.3 Andere Anwendungen
- 4 Referenzen
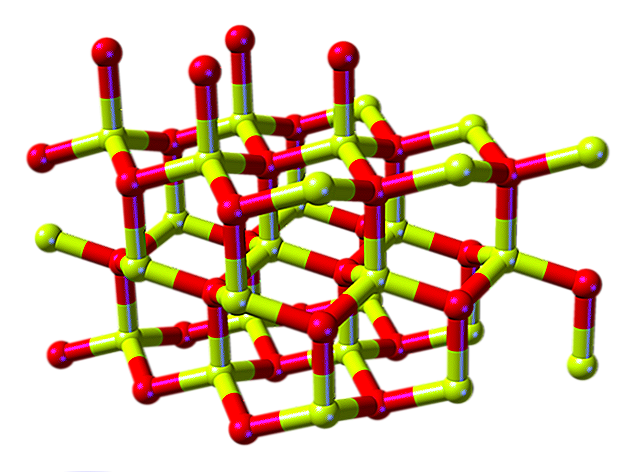
Chemische Struktur
Ein Molekül Berylliumoxid (auch genannt "Berilia") es besteht aus einem Berylliumatom und einem Sauerstoffatom, die beide in tetraedrischer Orientierung koordiniert sind und in hexagonalen kristallinen Strukturen, den Wurtziten, kristallisiert sind.
Diese Kristalle haben tetraedrische Zentren, die von Be besetzt sind2+ und O2-. Bei hohen Temperaturen wird die Struktur von Berylliumoxid tetragonal.
Die Gewinnung von Berylliumoxid wird durch drei Verfahren erreicht: die Calcinierung von Berylliumcarbonat, die Dehydratisierung von Berylliumhydroxid oder die Zündung von Berylliummetall. Das bei hohen Temperaturen gebildete Berylliumoxid ist inert, kann aber durch mehrere Verbindungen gelöst werden.
BeCO3 + Wärme → BeO + CO2 (Kalzinierung)
Sei (OH)2 → BeO + H2O (Dehydratation)
2 Sei + O2 → 2 BeO (Zündung)
Schließlich kann das Berylliumoxid verdampft werden, und in diesem Zustand wird es in Form von zweiatomigen Molekülen präsentiert.
Eigenschaften
Berylliumoxid kommt in der Natur als Bromellit vor, ein weißes Mineral, das in einigen komplexen Manganeisenvorkommen gefunden wird, aber häufiger in seiner synthetischen Form vorkommt: ein weißer amorpher Feststoff, der als Pulver produziert wird .
Verunreinigungen, die während der Produktion eingefangen wurden, geben der Oxidprobe eine Vielzahl von Farben.
Sein Schmelzpunkt ist 2507ºC, sein Siedepunkt ist 3900ºC und er hat eine Dichte von 3,01 g / cm²3.
In gleicher Weise ist seine chemische Stabilität beträchtlich, es reagiert nur mit Wasserdampf bei Temperaturen nahe 1000 ºC und kann Kohlenstoffreduktionsprozessen und Angriffen durch geschmolzene Metalle bei hohen Temperaturen standhalten.
Zusätzlich ist seine mechanische Festigkeit annehmbar und kann mit Designs und Herstellung verbessert werden, die für kommerzielle Anwendungen geeignet sind.
Elektrische Leitfähigkeit
Berylliumoxid ist ein sehr stabiles keramisches Material und weist daher einen ziemlich hohen spezifischen elektrischen Widerstand auf, der es zusammen mit Aluminiumoxid zu einem der besten elektrisch isolierenden Materialien macht.
Aus diesem Grund wird dieses Material häufig für spezialisierte Hochfrequenz-Elektrogeräte verwendet.
Wärmeleitfähigkeit
Berylliumoxid hat einen großen Vorteil in Bezug auf seine Wärmeleitfähigkeit: es ist als das zweitbeste wärmeleitende Material unter den Nichtmetallen bekannt und wird nur von Diamant übertroffen, einem beträchtlich teureren und selteneren Material.
Bei Metallen übertragen nur Kupfer und Silber Wärme besser durch Wärmeleitung als Berylliumoxid, was es zu einem sehr erwünschten Material macht.
Aufgrund seiner ausgezeichneten Wärmeleitfähigkeit ist diese Substanz an der Herstellung von Feuerfestmaterialien beteiligt.
Optische Eigenschaften
Aufgrund seiner kristallinen Eigenschaften wird Berylliumoxid für die Anwendung von ultraviolett-durchlässigem Material in bestimmten Flachbildschirmen und photovoltaischen Zellen verwendet.
Ebenso können Kristalle von sehr hoher Qualität hergestellt werden, so dass sich diese Eigenschaften entsprechend dem verwendeten Herstellungsverfahren verbessern.
Gesundheitsrisiken
Berylliumoxid ist eine Verbindung, die mit großer Vorsicht gehandhabt werden muß, da es als erstes krebserzeugende Eigenschaften besitzt, die mit der kontinuierlichen Inhalation von Pulvern oder Dämpfen dieses Materials verbunden sind.
Die kleinen Partikel in diesen Phasen des Oxids haften an der Lunge und können die Bildung von Tumoren oder einer Krankheit, die als Berylliose bekannt ist, hervorrufen.
Berylliose ist eine Krankheit mit einer mittleren Sterblichkeitsrate, die ineffiziente Atmung, Husten, Gewichtsverlust und Fieber sowie die Bildung von Granulomen in der Lunge oder anderen betroffenen Organen verursacht.
Es besteht auch Gesundheitsgefahr durch direkten Kontakt von Berylliumoxid mit der Haut, da es ätzend und reizend ist und Schäden an der Hautoberfläche und den Schleimhäuten verursachen kann. Die Atemwege und Hände sollten bei der Arbeit mit diesem Material, insbesondere in seiner Pulverform, geschützt werden.
Verwendet
Die Anwendungen von Berylliumoxid werden hauptsächlich in drei Bereiche unterteilt: elektronische, nukleare und andere Anwendungen.
Elektronische Anwendungen
Die Fähigkeit, Wärme auf ein hohes Niveau zu übertragen, und sein guter elektrischer Widerstand haben dazu geführt, dass das Berylliumoxid eine große Nützlichkeit als Wärmesenke erlangt.
Seine Verwendung wurde in den Schaltungen in Computern mit hoher Kapazität nachgewiesen, zusätzlich zu Geräten, die hohe Ströme von Elektrizität handhaben.
Berylliumoxid ist für Röntgenstrahlen und Mikrowellen transparent, so dass es in Fenstern gegen diese Arten von Strahlung sowie für Antennen, Kommunikationssysteme und Mikrowellenöfen verwendet wird.
Nukleare Anwendungen
Seine Fähigkeit, Neutronen zu mäßigen und ihre Struktur unter Beschuß von Strahlung aufrechtzuerhalten, hat dazu geführt, daß das Berylliumoxid an der Konstruktion von Kernreaktoren beteiligt ist, und kann auch in Hochtemperaturreaktoren angewendet werden, die durch Gase gekühlt werden.
Andere Anwendungen
Die geringe Dichte von Berylliumoxid hat Interesse in der Luft- und Raumfahrt- und Militärtechnologieindustrie geweckt, da es eine leichte Option in Raketentriebwerken und kugelsicheren Westen darstellen kann.
Schließlich wurde es kürzlich als ein feuerfestes Material bei der Fusion von Metallen in metallurgischen Industrien angewendet.
Referenzen
- PubChem. (s.). Berylliumoxid. Von publem.ncbi.nlm.nih.gov abgerufen
- Reagieren. (s.). Berylliumoxid / Berylliumoxid (BeO). Von reade.com wiederhergestellt
- Research, C. (s.f.). Berylliumoxid - Berylliumoxid. Von azom.com abgerufen
- Services, N.J. (s.f.). Berylliumoxid. Von nj.gov abgerufen
- Wikipedia. (s.). Berylliumoxid. Von en.wikipedia.org abgerufen


