Oxiden Nomenklatur, Typen, Eigenschaften und Beispiele
Die Oxide sie sind eine Familie von binären Verbindungen, in denen Wechselwirkungen zwischen dem Element und Sauerstoff bestehen. Ein Oxid hat also eine sehr allgemeine Formel vom EO-Typ, wobei E irgendein Element ist.
Abhängig von vielen Faktoren, wie der elektronischen Natur von E, seinem Ionenradius und seinen Valenzen, können verschiedene Arten von Oxiden gebildet werden. Einige sind sehr einfach und andere wie Pb3O4, (genannt minium, arcazón oder rote Leitung) werden gemischt; das heißt, sie resultieren aus der Kombination von mehr als einem einfachen Oxid.

Aber die Komplexität der Oxide kann noch weiter gehen. Es gibt Mischungen oder Strukturen, in die mehr als ein Metall eingreifen kann und in denen die Anteile nicht stöchiometrisch sind. Im Fall von Pb3O4, ist das Pb / O-Verhältnis gleich 3/4, wobei sowohl der Zähler als auch der Nenner ganze Zahlen sind.
In nicht-stöchiometrischen Oxiden sind die Anteile Dezimalzahlen. Die E0.75O1.78ist ein Beispiel für ein hypothetisches nicht-stöchiometrisches Oxid. Dieses Phänomen tritt bei den sogenannten Metalloxiden auf, insbesondere bei den Übergangsmetallen (Fe, Au, Ti, Mn, Zn usw.).
Es gibt jedoch Oxide, deren Eigenschaften viel einfacher und differenzierbarer sind, ebenso wie der ionische oder kovalente Charakter. In diesen Oxiden, in denen der ionische Charakter vorherrscht, werden sie aus Kationen E bestehen+ und Anionen O2-; und jene rein kovalenten, die einfachen (E-O) oder doppelten (E = O) Bindungen.
Was den ionischen Charakter eines Oxids vorschreibt, ist der Unterschied in der Elektronegativität zwischen E und O. Wenn E ein sehr elektropositives Metall ist, wird EO einen hohen ionischen Charakter haben. Während wenn E elektronegativ ist, nämlich ein Nichtmetall, wird sein EO-Oxid kovalent sein.
Diese Eigenschaft definiert viele andere Eigenschaften der Oxide, ebenso wie ihre Fähigkeit, Basen oder Säuren in wässriger Lösung zu bilden. Daraus entstehen die sogenannten basischen und sauren Oxide. Diejenigen, die sich nicht wie beide verhalten oder die beide Eigenschaften aufweisen, sind neutrale oder amphotere Oxide.
Index
- 1 Nomenklatur
- 1.1 Systematische Nomenklatur
- 1.2 Bestandsnomenklatur
- 1.3 Traditionelle Nomenklatur
- 2 Arten von Oxiden
- 2.1 Grundoxide
- 2.2 Saueroxide
- 2.3 Neutrale Oxide
- 2.4 Amphotere Oxide
- 2.5 Mischoxide
- 3 Eigenschaften
- 4 Wie sind sie gebildet?
- 5 Beispiele für Oxide
- 5.1 Übergangsmetalloxide
- 5.2 Weitere Beispiele
- 6 Referenzen
Nomenklatur
Es gibt drei Möglichkeiten, Oxide zu erwähnen (die auch für viele andere Verbindungen gelten). Diese sind ungeachtet des ionischen Charakters des EO-Oxids korrekt, so dass ihre Namen nichts über ihre Eigenschaften oder Strukturen aussagen.
Systematische Nomenklatur
Angesichts der Oxide EO, E2O, E2O3 und EO2Auf den ersten Blick kann man nicht wissen, was sich hinter ihren chemischen Formeln verbirgt. Die Zahlen geben jedoch die stöchiometrischen Anteile oder das E / O-Verhältnis an. Aus diesen Zahlen können sie benannt werden, obwohl nicht angegeben ist, mit welcher Valenz "funktioniert" E.
Die Anzahl der Atome für E und O ist durch die griechischen Zahlenpräfixe angegeben. Auf diese Weise bedeutet mono, dass es nur ein Atom gibt; zwei Atome; Tri-, drei Atome und so weiter.
Dann sind die Namen der vorhergehenden Oxide gemäß der systematischen Nomenklatur:
-MonóE (EO) -Oxid.
-MonóXido diE (E2O).
-TriOxid von diE (E2O3).
-DiE-Oxid (EO2).
Anwenden dann diese Nomenklatur für den Pb3O4, das rote Oxid des ersten Bildes, haben wir:
Pb3O4: tetraOxid von triFühren
Für viele gemischte Oxide oder mit hohen stöchiometrischen Verhältnissen ist es sehr nützlich, auf die systematische Nomenklatur zurückzugreifen, um sie zu benennen.
Stock-Nomenklatur
Valencia
Obwohl nicht bekannt ist, welches Element E ist, reicht es mit dem E / O-Verhältnis zu wissen, welche Valenz es in seinem Oxid verwendet. Wie? Durch das Prinzip der Elektroneutralität. Dies erfordert, dass die Summe der Ladungen der Ionen in einer Verbindung gleich Null sein muss.
Dies geschieht, indem für jedes Oxid ein hoher ionischer Charakter angenommen wird. Also hat das O Ladung -2, weil es O ist2-und E muss n + liefern, damit es die negativen Ladungen des Oxidanions neutralisiert.
Zum Beispiel arbeitet das Atom E im EO mit Valenz +2. Warum? Denn sonst könnte es die Last -2 des einzigen O nicht neutralisieren. Für die E2Oder das E hat Valenz +1, da die Ladung +2 zwischen den beiden Atomen von E aufgeteilt werden muss.
Und in der E2O3, müssen zuerst die vom O beigetragenen negativen Ladungen berechnet werden. Wie drei von ihnen, dann gilt: 3 (-2) = -6.Um die Last -6 zu neutralisieren, ist es erforderlich, dass das E +6 liefert, aber da es zwei davon gibt, wird +6 durch zwei geteilt, wobei E mit einer Wertigkeit von +3 zurückbleibt.
Mnemonic Regel
O hat immer Valenz -2 in den Oxiden (außer es ist ein Peroxid oder Superoxid). Eine mnemonische Regel, um die Wertigkeit von E zu bestimmen, ist einfach, die Zahl zu berücksichtigen, die das O begleitet. E wird seinerseits die Zahl 2 haben, die es begleitet, und wenn nicht, bedeutet es, dass es eine Vereinfachung gab.
Zum Beispiel ist in EO die Valenz von E +1, denn selbst wenn es nicht geschrieben ist, gibt es nur ein O. Und für das EO2Da es kein 2 begleitendes E gibt, gab es eine Vereinfachung, und um es erscheinen zu lassen, muss es mit 2 multipliziert werden. Somit bleibt die Formel wie E2O4 und die Wertigkeit von E ist dann +4.
Diese Regel versagt jedoch bei einigen Oxiden wie Pb3O4. Daher ist es immer notwendig, die Neutralitätsberechnungen durchzuführen.
Woraus besteht es?
Wenn man einmal die Wertigkeit von E hat, besteht die Nomenklatur des Lagers darin, sie in Klammern und mit römischen Zahlen zu spezifizieren. Von allen Nomenklaturen ist dies hinsichtlich der elektronischen Eigenschaften der Oxide am einfachsten und präzisesten.
Wenn E andererseits nur eine Valenz hat (die im Periodensystem gefunden werden kann), ist es nicht spezifiziert.
Wenn also für das Oxid EO E die Wertigkeit +2 und +3 hat, heißt es: Oxid von (Name von E) (II). Aber wenn E nur Valenz +2 hat, dann heißt sein Oxid: Oxid (Name von E).
Traditionelle Nomenklatur
Um den Namen der Oxide zu erwähnen, sollten die Suffixe -ico oder -oso für die größeren oder kleineren Valenzen ihren lateinischen Namen hinzugefügt werden. Falls es mehr als zwei gibt, werden die Präfixe -hype, für die kleinste und -per, für die größte von allen verwendet.
Zum Beispiel arbeitet Blei mit Valenzen +2 und +4. Im PbO hat es die Valenz +2, daher heißt es: Bleioxid. Während der PbO2 Es heißt: Plumic Oxid.
Und der Pb3O4Wie heißt es nach den beiden vorherigen Nomenklaturen? Es hat keinen Namen. Warum? Weil der Pb3O4 besteht eigentlich aus einer Mischung 2 [PbO] [PbO2]; das heißt, der rote Feststoff hat eine doppelte Konzentration von PbO.
Aus diesem Grund wäre es falsch zu versuchen, dem Pb einen Namen zu geben3O4 das besteht nicht aus der systematischen Nomenklatur oder dem populären Slang.
Arten von Oxiden
Abhängig davon, welcher Teil des Periodensystems E ist und daher seine elektronische Natur, kann ein Oxidtyp oder ein anderer Oxidtyp gebildet werden. Daraus ergeben sich mehrere Kriterien, um ihnen einen Typ zuzuordnen, aber die wichtigsten sind diejenigen, die sich auf ihre Säure oder Basizität beziehen.
Basische Oxide
Die basischen Oxide sind dadurch gekennzeichnet, dass sie ionisch, metallisch und wichtiger sind, wobei sie eine basische Lösung erzeugen, wenn sie in Wasser gelöst werden. Um experimentell zu bestimmen, ob ein Oxid basisch ist, muss es in einen Behälter gegeben werden, in dem Wasser und ein Universalindikator gelöst sind. Seine Färbung vor der Zugabe des Oxids muss grün sein, neutraler pH-Wert.
Wenn das Oxid einmal dem Wasser hinzugefügt wurde, bedeutet das, wenn sich seine Farbe von grün zu blau ändert, dass der pH-Wert basisch geworden ist. Dies liegt daran, dass es ein Gleichgewicht der Löslichkeit zwischen dem gebildeten Hydroxid und dem Wasser herstellt:
EO (s) + H2O (I) => E (OH)2(s) <=> E2+(ac) + OH-(ac)
Obwohl das Oxid in Wasser unlöslich ist, ist es ausreichend, dass sich ein kleiner Teil auflöst, um den pH-Wert zu modifizieren. Einige basische Oxide sind so löslich, dass sie ätzende Hydroxide wie NaOH und KOH erzeugen. Das heißt, die Oxide von Natrium und Kalium, Na2O und K2Oder sie sind sehr einfach. Beachten Sie die Valenz von +1 für beide Metalle.
Saure Oxide
Saure Oxide sind dadurch gekennzeichnet, dass sie ein nichtmetallisches Element aufweisen, kovalent sind und auch saure Lösungen mit Wasser erzeugen. Auch hier kann der Säuregehalt mit dem Universalindikator überprüft werden. Wenn dieses Mal das Oxid zum Wasser hinzugefügt wird, wird seine grüne Farbe rötlich, dann ist es ein saures Oxid.
Welche Reaktion findet statt? Das Folgende:
EO2(s) + H2O (l) => H2EO3(ac)
Ein Beispiel für ein saures Oxid, das kein Feststoff, sondern ein Gas ist, ist CO2. Wenn es sich in Wasser auflöst, bildet es Kohlensäure:
CO2(g) + H2O (l) <=> H2CO3(ac)
Ebenso ist das CO2 Es besteht nicht aus Anionen O2- und C-Kationen4+, aber in einem Molekül, das durch kovalente Bindungen gebildet wird: O = C = O. Dies ist vielleicht einer der größten Unterschiede zwischen basischen Oxiden und Säuren.
Neutrale Oxide
Diese Oxide verändern die grüne Farbe von Wasser bei neutralem pH nicht; das heißt, sie bilden keine Hydroxide oder Säuren in wässriger Lösung. Einige von ihnen sind: N2O, NO und CO. Wie CO haben sie kovalente Bindungen, die durch Lewis-Strukturen oder irgendeine Verbindungstheorie veranschaulicht werden können.
Amphotere Oxide
Eine andere Möglichkeit, die Oxide zu klassifizieren, hängt davon ab, ob sie mit einer Säure reagieren oder nicht.Wasser ist eine sehr schwache Säure (und auch eine Base), so dass amphotere Oxide nicht "beide Seiten" aufweisen. Diese Oxide sind dadurch gekennzeichnet, dass sie sowohl mit Säuren als auch mit Basen reagieren.
Aluminiumoxid ist beispielsweise ein amphoteres Oxid. Die folgenden zwei chemischen Gleichungen stellen ihre Reaktion mit Säuren oder Basen dar:
Al2O3(s) + 3H2SO4(ac) => Al2(SO4)3(ac) + 3H2O (l)
Al2O3(s) + 2NaOH (ac) + 3H2O (I) => 2NaAl (OH)4(ac)
Das Al2(SO4)3 ist das Aluminiumsulfatsalz und NaAl (OH)4 ein komplexes Salz, das Natriumtetrahydroxyaluminat genannt wird.
Wasserstoffoxid, H2Oder (Wasser) ist es auch amphoter, und dies zeigt sich in seinem Ionisationsgleichgewicht:
H2O (l) <=> H3O+(ac) + OH-(ac)
Mischoxide
Mischoxide sind solche, die aus der Mischung von einem oder mehreren Oxiden in demselben Feststoff bestehen. Der Pb3O4 Es ist ein Beispiel für sie. Der Magnetit, Glaube3O4, ist auch ein anderes Beispiel für ein Mischoxid. Der Glaube3O4 Es ist eine Mischung aus FeO und Fe2O3 in 1: 1 Proportionen (im Gegensatz zu Pb)3O4).
Die Mischungen können komplexer sein und somit eine reiche Vielfalt von Oxidmineralien hervorbringen.
Eigenschaften
Die Eigenschaften der Oxide hängen von ihrem Typ ab. Die Oxide können ionisch sein (En +O2-) wie CaO (Ca2+O2-) oder kovalent wie SO2, O = S = O.
Aus dieser Tatsache und aus der Tendenz der Elemente, mit Säuren oder Basen zu reagieren, wird eine Anzahl von Eigenschaften für jedes Oxid gesammelt.
Das oben Gesagte spiegelt sich auch in physikalischen Eigenschaften wie Schmelz- und Siedepunkten wider. Die ionischen Oxide neigen dazu, kristalline Strukturen zu bilden, die sehr hitzebeständig sind, so dass ihre Schmelzpunkte hoch sind (über 1000 ° C), während die kovalenten Schmelzen bei niedrigen Temperaturen oder sogar Gase oder Flüssigkeiten sind.
Wie sind sie gebildet?
Wenn die Elemente mit Sauerstoff reagieren, bilden sich Oxide. Diese Reaktion kann bei einfachem Kontakt mit sauerstoffreichen Atmosphären auftreten oder erfordert Wärme (wie die Flamme eines Feuerzeugs). Das heißt, wenn ein Objekt verbrannt wird, reagiert es mit Sauerstoff (solange es in der Luft vorhanden ist).
Wenn zum Beispiel ein Stück Phosphor genommen und in die Flamme gelegt wird, brennt es und bildet das entsprechende Oxid:
4 P (s) + 5 O2(g) => P4O10(s)
Während dieses Prozesses können einige Feststoffe, wie Kalzium, mit einer hellen und bunten Flamme brennen.
Ein anderes Beispiel wird durch das Verbrennen von Holz oder einer organischen Substanz, die Kohlenstoff enthält, erhalten:
C (s) + O2(g) => CO2(G)
Bei Sauerstoffmangel entsteht CO statt CO2:
C (s) + 1 / 2O2(g) => CO (g)
Beachten Sie, wie das C / O-Verhältnis zur Beschreibung verschiedener Oxide verwendet wird.
Beispiele für Oxide
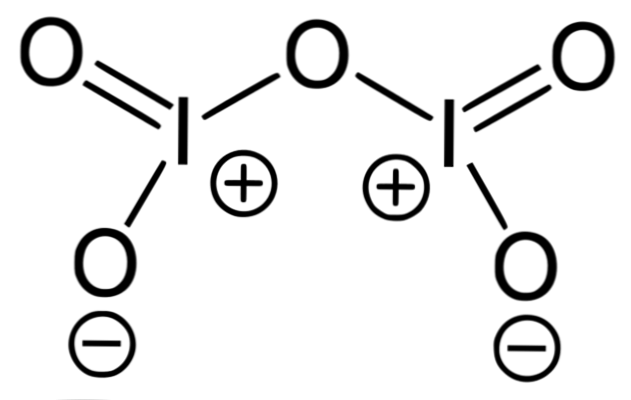
Das obere Bild entspricht der kovalenten Oxidstruktur I2O5, die stabilste Form von Jod. Man beachte seine einfachen und doppelten Bindungen sowie die formalen Ladungen von I und Sauerstoff auf seinen Seiten.
Die Halogenoxide sind dadurch gekennzeichnet, dass sie kovalent und sehr reaktiv sind, wie dies bei O der Fall ist2F2 (F-O-O-F) und OF2 (F-O-F). Chlordioxid, ClO2zum Beispiel ist das einzige Chloroxid, das in industriellen Maßstäben synthetisiert wird.
Da Halogene kovalente Oxide bilden, werden ihre "hypothetischen" Valenzen in gleicher Weise durch das Prinzip der Elektroneutralität berechnet.
Übergangsmetalloxide
Neben den Halogenoxiden haben wir die Oxide der Übergangsmetalle:
-CoO: Cobaltoxid (II); Kobaltoxid; Kobaltmonoxid.
-HgO: Quecksilberoxid (II); Quecksilberoxid; du Quecksilbermonoxid.
-G2O: Silberoxid; Silberoxid; oder Diplatamonoxid.
-Au2O3: Goldoxid (III); Aureioxid; oder Ditrioxid.
Zusätzliche Beispiele
-B2O3: Boroxid; Boroxid; oder Dibortrioxid.
-Cl2O7: Chloroxid (VII); Perchloroxid; Dichlorheptoxid.
-NO: Stickstoffoxid (II); Stickstoffmonoxid; Stickstoffmonoxid.
Referenzen
- Zittern und Atkins. (2008). Anorganische Chemie (vierte Ausgabe). Mc Graw Hill.
- Metall- und Nichtmetalloxide. Genommen von: chem.uiuc.edu
- Freie Chemie online. (2018). Oxide und Ozon. Genommen von: freechemistryonline.com
- Toppr. (2018). Einfache Oxide. Genommen von: toppr.com
- Steven S. Zumdahl. (7. Mai 2018). Oxid. Enzyklopädie Britannica. Genommen von: britannica.com
- Chemie LibreTexte. (24. April 2018). Oxide Genommen von: chem.libretexts.org
- Quimicas.net (2018). Beispiele für Oxide. Wiederhergestellt von: quimicas.net


