Theorie der Bänder Modell und Beispiele
Die Bandtheorie ist eine, die die elektronische Struktur des Körpers als Ganzes definiert. Es kann auf jede Art von Festkörpern angewendet werden, aber es ist in den Metallen, wo seine größten Erfolge widergespiegelt werden. Nach dieser Theorie resultiert die metallische Bindung aus der elektrostatischen Anziehung zwischen den positiv geladenen Ionen und den beweglichen Elektronen im Kristall.
Daher hat der metallische Kristall ein "Elektronenmeer", das seine physikalischen Eigenschaften erklären kann. Das untere Bild zeigt die Metallverbindung. Die violetten Punkte der Elektronen sind in einem Meer delokalisiert, das die positiv geladenen Metallatome umgibt.

Das "Elektronenmeer" wird aus den einzelnen Beiträgen jedes Metallatoms gebildet. Diese Beiträge sind seine Atomorbitale. Die Metallstrukturen sind im Allgemeinen kompakt; Je kompakter sie sind, desto größer sind die Wechselwirkungen zwischen ihren Atomen.
Folglich überlappen sich ihre Atomorbitale, um sehr enge Molekülorbitale in Energie zu erzeugen. Das Meer von Elektronen ist dann nur ein großer Satz von Molekülorbitalen mit verschiedenen Bereichen von Energien. Die Reichweite dieser Energien bilden sogenannte Energiebänder.
Diese Banden sind in jeder Region des Kristalls vorhanden, weshalb sie als Ganzes betrachtet werden, und daher die Definition dieser Theorie.
Index
- 1 Modell der Energiebänder
- 1.1 Fermi-Niveau
- 2 Halbleiter
- 2.1 Intrinsische und extrinsische Halbleiter
- 3 Beispiele für angewandte Bandtheorie
- 4 Referenzen
Energiebandmodell

Wenn das s-Orbital eines Metallatoms mit dem seines Nachbarn (N = 2) wechselwirkt, entstehen zwei Molekülorbitale: eine Bindung (grüne Bande) und eine Anti-Bindung (dunkelrote Bande).
Wenn N = 3 ist, werden nun drei Molekülorbitale gebildet, von denen das mittlere (schwarze Band) nicht bindend ist. Wenn N = 4 ist, werden vier Orbitale gebildet und dasjenige mit dem größten Bindungscharakter und dasjenige mit dem größten Frostschutzcharakter werden weiter getrennt.
Der für die Molekülorbitale verfügbare Energiebereich erweitert sich, da die Metallatome des Kristalls ihre Orbitale liefern. Dies führt auch zu einer Verringerung des Energieraums zwischen den Orbitalen bis zu dem Punkt, an dem sie in einem Band kondensieren.
Diese aus Orbitalen bestehende Bande hat Regionen mit niedriger Energie (solche mit grünen und gelben Farben) und mit hoher Energie (mit orangefarbenen und roten Farben). Ihre energetischen Enden haben eine geringe Dichte; die meisten Molekülorbitale (weißer Streifen) sind jedoch in der Mitte konzentriert.
Dies bedeutet, dass die Elektronen durch die Bandmitte "schneller" laufen als an ihren Enden.
Fermi-Niveau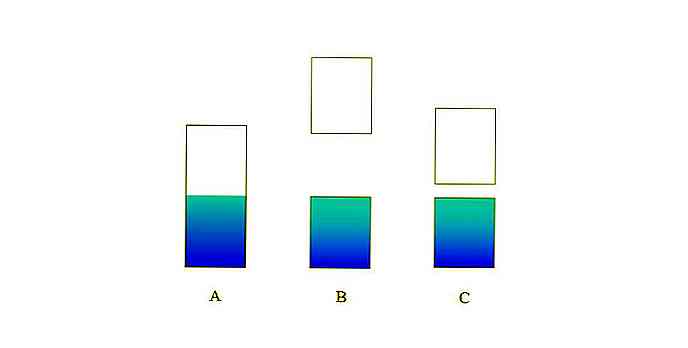
Es ist der höchste Energiezustand, der von Elektronen in einem Festkörper bei der absoluten Null-Temperatur eingenommen wird (T = 0 K).
Sobald das S-Band aufgebaut ist, beginnen die Elektronen alle ihre Molekülorbitale zu besetzen. Wenn das Metall ein einzelnes Valenzelektron hat1), nehmen alle Elektronen in ihrem Kristall die Hälfte der Bande ein.
Die andere unbesetzte Hälfte ist als treibende Band bekannt, während die Bande voller Elektronen das Valenzband genannt wird.
In dem oberen Bild repräsentiert A ein typisches Valenzband (blau) und Leitungsband (weiß) für ein Metall. Die bläuliche Begrenzungslinie zeigt das Fermi-Niveau an.
Weil Metalle auch p-Orbitale haben, kombinieren sie auf die gleiche Weise eine p-Bande (weiß).
Bei Metallen liegen die s- und p-Banden sehr nahe bei der Energie. Dies ermöglicht ihre Überlappungen, die Elektronen vom Valenzband zum Leitungsband fördern. Das Obige passiert sogar bei Temperaturen wenig über 0 K.
Für die Übergangsmetalle und ab Periode 4 nach unten ist auch die Bildung von Bändern d möglich.
Das Fermi-Niveau in Bezug auf das Leitungsband ist sehr wichtig, um die elektrischen Eigenschaften zu bestimmen.
Zum Beispiel hat ein Metall Z mit einem Fermi-Niveau, das sehr nahe am Leitungsband liegt (das energetisch nächstliegende leere Band), eine höhere elektrische Leitfähigkeit als ein Metall X, in dem sein Fermi-Niveau weit von diesem Band entfernt ist.
Halbleiter
Die elektrische Leitfähigkeit besteht dann aus der Wanderung von Elektronen von einem Valenzband zu einem Leitungsband.
Wenn die Energielücke zwischen beiden Bändern sehr groß ist, haben Sie einen isolierenden Feststoff (wie bei B). Wenn diese Lücke andererseits relativ klein ist, ist der Festkörper ein Halbleiter (im Fall von C).
Angesichts einer Temperaturerhöhung erhalten die Elektronen des Valenzbandes genügend Energie, um zum Leitungsband zu wandern. Dies führt zu einem elektrischen Strom.
Tatsächlich ist dies eine Eigenschaft von Festkörpern oder Halbleitermaterialien: Bei Raumtemperatur sind sie Isolatoren, aber bei hohen Temperaturen sind sie Leiter.
Intrinsische und extrinsische Halbleiter

Intrinsische Leiter sind solche, bei denen die Energielücke zwischen dem Valenzband und dem Leitungsband klein genug ist, so dass die thermische Energie den Durchgang von Elektronen ermöglicht.
Auf der anderen Seite zeigen extrinsische Leiter nach dem Dotieren mit Verunreinigungen Veränderungen in ihren elektronischen Strukturen, die ihre elektrische Leitfähigkeit erhöhen. Diese Verunreinigung kann ein anderes Metall oder ein nichtmetallisches Element sein.
Wenn die Verunreinigung mehr Valenzelektronen aufweist, kann sie eine Donorbande bereitstellen, die als eine Brücke für die Elektronen des Valenzbandes dient, um in das Leitungsband einzudringen. Diese Feststoffe sind Halbleiter vom n-Typ. Hier kommt der Nennwert n von "negativ".
Im oberen Bild ist das Donorband im blauen Block unterhalb der treibenden Bande (Typ n) dargestellt.
Wenn die Verunreinigung andererseits weniger Valenzelektronen aufweist, stellt sie eine Akzeptorbande bereit, die die Energielücke zwischen dem Valenzband und dem Leitungsband verkürzt.
Die Elektronen wandern zuerst zu diesem Band und hinterlassen "positive Löcher", die sich in die entgegengesetzte Richtung bewegen.
Da diese positiven Lücken den Durchgang von Elektronen markieren, ist der Feststoff oder das Material ein p-Typ-Halbleiter.
Beispiele für angewandte Bandtheorie
- Erkläre, warum Metalle hell sind: Ihre mobilen Elektronen können Strahlung über einen weiten Wellenlängenbereich absorbieren, wenn sie zu höheren Energieniveaus springen. Dann emittieren sie Licht und kehren zu niedrigeren Pegeln des treibenden Bandes zurück.
- Kristallines Silizium ist das wichtigste Halbleitermaterial. Wenn ein Teil von Silizium mit Spuren eines Elements der Gruppe 13 (B, Al, Ga, In, Tl) dotiert ist, wird es ein p-Typ-Halbleiter. Wenn es jedoch mit einem Element der Gruppe 15 (N, P, As, Sb, Bi) dotiert ist, wird es ein n-Typ-Halbleiter.
- Leuchtdioden (LED) ist ein Halbleiter der Verbindung p-n. Was meinst du? Dass das Material beide Arten von Halbleitern hat, sowohl das n als auch das p. Die Elektronen wandern vom Leitungsband des Halbleiters vom n-Typ zum Valenzband des Halbleiters vom p-Typ.
Referenzen
- Whitten, Davis, Peck und Stanley. Chemie (8. Ausgabe). CENGE Learning, S. 486-490.
- Zittern und Atkins. (2008). Anorganische Chemie (Vierte Ausgabe, Pp. 103-107, 633-635). Mc Graw Hill.
- Schiff C. R. (2016). Bandtheorie der Festkörper. Abgerufen am 28. April 2018 von: hyperphysics.phy-astr.gsu.edu
- Steve Kornic. (2011). Von Bonds zu Bands aus der Sicht des Chemikers gehen. Abgerufen am 28. April 2018 von: chembio.uoguelph.ca
- Wikipedia. (2018). Extrinsischer Halbleiter. Abgerufen am 28. April 2018 von: en.wikipedia.org
- Byjus (2018). Bandtheorie von Metallen. Abgerufen am 28. April 2018 von: byjus.com



